
2025-11-12 01:31:23
湖州申科構建了具有完備資質的支原體技術服務平臺,為企業提供多元化支持。平臺擁有 BSL-2/P2 微生物實驗室備案資質,遵循 GMP-like 質量體系,具備支原體培養法、指示細胞法與 qPCR 法的檢測及驗證能力,配備符合藥典要求的支原體標準菌株庫與高靈敏度培養基(含液體、固體、半流體)。企業已通過 ISO13485:2016 質量管理體系認證(證書號 MD 709873),檢測中心獲得 CNAS 認證(注冊號 CNAS L21942),符合 ISO/IEC 17025:2017 標準,具備國際互認資質。平臺可提供多元化技術服務,包括支原體 qPCR 法檢測能力建立、實驗員能力考核、質量體系與流程搭建、實驗室設計方案優化,以及樣品檢測(三種方法)、樣品適用性驗證、方法學驗證、傳統法與 qPCR 法比對、特殊菌株定制生產等,申報階段可配合客戶與監管機構完成現場審計。 湖州申科支原體檢測快速版試劑盒 2-2.5 小時出結果,適配緊急放行,滿足細胞療法時效需求。江蘇干細胞產品支原體檢測國產替代
針對不同類型的樣品基質,需采用定制化的支原體檢測前處理方案,以消除干擾、提升檢測效果。細胞懸液需經熱處理、樣品處理液作用、細胞碎片去除、濃縮離心,再 55℃消化;上清或高濃度質粒樣品需先濃縮離心,再用樣品處理液作用后 55℃消化;5% 人血白蛋白樣品則采用濃縮離心 + 樣品處理液作用 + 25℃消化的流程。常見干擾基質包括凍存保護劑、高濃度細胞、代謝產物等,優化前處理可遵循三大原則:提取前通過離心取上清或去除抑制劑預處理樣品;高濃度蛋白樣本提取時增加蛋白酶 K 用量,增強蛋白降解效果;細胞類樣品適當降低細胞數或先裂解細胞,減少細胞基質對檢測的干擾。 重慶重組藥物支原體檢測核酸擴增法全血基質中100 CFU/mL支原體,湖州申科支原體檢測試劑盒通過優化提取流程實現穩定擴增與檢出。
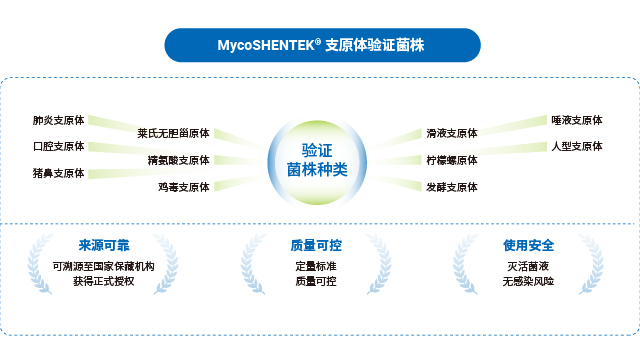
全球主流藥典對支原體 NAT 檢測的標準菌株選擇形成了明確共識,中國、歐洲、美國、日本四國藥典一致推薦優先使用豬鼻支原體、口腔支原體、肺炎支原體三種菌株,用于 NAT 方法檢測限的驗證,這一選擇基于支原體的污染發生頻率與進化關系。不同地區法規的驗證范圍略有差異:EP、USP、ChP 要求覆蓋特異性、檢測限、耐受性,WHO 還需包含半定量與定性實驗;部分地區如歐洲藥典額外納入萊氏無膽甾原體、滑液支原體等菌株,針對昆蟲和植物來源物料生產場景則需關注螺原體等特殊菌株。合規的標準菌株是 NAT 檢測方法驗證的前提,其溯源性與授權資質直接影響檢測結果的認可度。
質控結果是支原體 NAT 檢測可靠性的前提,需嚴格遵循判定標準,且需結合實驗室實際條件驗證適配的標準閾值。質控樣品的判定規則明確:NTC(無模板對照)的 FAM 信號需 2 復孔 Ct≥40 或無明顯擴增曲線,VIC 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增;NCS(陰性對照)判定標準與 NTC 一致;PC(陽性質控)的 FAM 信號需 2 復孔 Ct<35 且呈有效 “S” 型擴增,PCS(陽性對照底物)判定標準與 PC 一致。只有質控結果全部滿足要求,才能進一步分析樣本結果,若質控不達標,需排查設備、試劑、操作等環節的問題并重新檢測。 一體化支原體檢測卡盒集成全流程,相當于迷你 qPCR 實驗室,普通環境即可使用。
抑制物質檢測是支原體培養法的關鍵前置環節,旨在排除供試品中抑制成分對檢測的干擾。湖州申科按 USP 標準執行:對供試品進行一次抑制物質檢測,若生產方法發生變化可能影響支原體檢測結果,需重復該檢測。檢測通過兩組平行實驗對比實現:一組培養基加入供試品,另一組不加供試品,同步開展營養特性測試,判斷供試品是否含抑制物質。若檢出抑制物質,需通過適當方法中和或抵消其作用,例如使用不含抑制劑的底物,或將供試品稀釋在更大體積的培養基中,確保支原體能在檢測體系中正常生長,避免因抑制成分導致檢測結果失真。 復雜基質樣品(如10?細胞、5%人白)檢測中,MycoSHENTEK支原體檢測試劑盒抗干擾能力突出。重慶重組藥物支原體檢測核酸擴增法
湖州申科已為多家頭部企業提供支原體檢測方案,支持 BLA/NDA 申報。江蘇干細胞產品支原體檢測國產替代
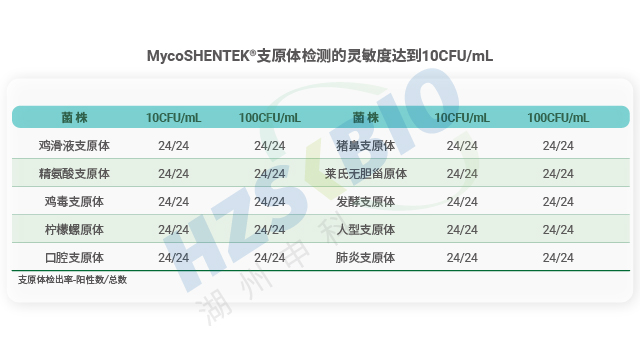
支原體檢測 NAT 方法驗證需滿足全球藥典對檢測限、專屬性、耐用性、可比性等關鍵指標的要求,且 EP、USP 新草案提出更嚴格標準。檢測限(LOD)方面,EP 要求針對每種支原體確定臨界值,需 3 次單獨 10 倍梯度稀釋、共 24 個檢測數據,95% 檢出濃度達標;USP 要求標準菌株濃度≤10 CFU/mL 或 100 GC/mL,≥24 次檢測數據支持統計分析;ChP 未明確支原體專屬要求,但需滿足 “微生物檢出下限數量” 設定標準。專屬性上,EP 建議測試革蘭氏陽性菌交叉污染,USP 要求生信分析與實際樣品驗證結合,ChP 強調外來成分不干擾試驗。耐用性方面,EP 需驗證試劑濃度、提取與反應程序變化,USP 涵蓋設備、反應體系等參數波動。可比性上,EP 要求 NAT 法與藥典法 LOD 及特異性對比,替代培養法需達 10 CFU/mL,替代指示細胞法需達 100 CFU/mL,USP 則視樣品基質情況要求可比性研究。 江蘇干細胞產品支原體檢測國產替代