
2025-11-12 07:30:55
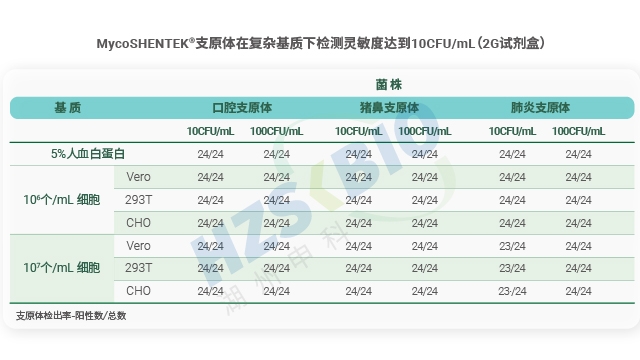
檢測限驗證是支原體 NAT 方法(核酸擴增法)合規性的關鍵要求,法規明確界定需為每種目標支原體確定陽性檢測臨界值。驗證流程需滿足嚴格的實驗設計:每種支原體至少進行三次單獨的 10 倍梯度稀釋,每次稀釋后需制備平行管檢測,再確保各稀釋濃度獲得 24 個檢測結果。陽性臨界值的判定標準為,該濃度下至少 95% 的試驗運行能得到陽性結果,即 24 個樣品中需至少出現 23 個有效陽性結果。這一嚴謹設計旨在確保 NAT 檢測方法在實際應用中,能夠穩定檢出低濃度支原體污染,避免因檢測靈敏度不足導致的**風險,為生物制品質量控制提供可靠保障。 支原體檢測全自動系統用封閉微流控卡盒,只需一步加樣,降低氣溶膠污染風險。上海重組藥物支原體檢測核酸擴增法
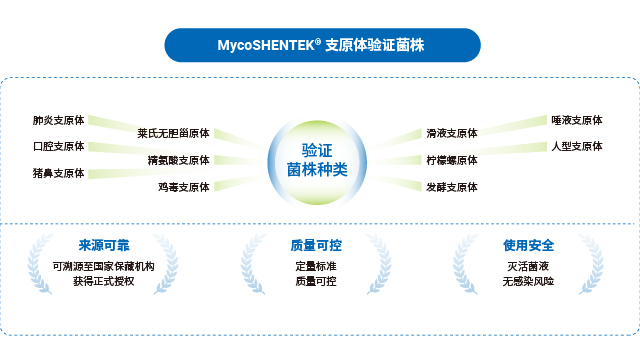
湖州申科生物構建了完整的支原體檢測解決方案,包含支原體 DNA 提取純化試劑盒與檢測試劑盒兩大產品。提取純化試劑盒采用磁珠法技術,具有回收率高、樣品兼容性強的優勢,配合湖州申科 rHCDpurify®前處理系統可實現自動化提取操作,大幅提升檢測效率并減少人為誤差。檢測試劑盒采用 PCR - 熒光探針法,覆蓋近200種支原體 DNA 序列,檢測專一性強,且對不同品牌 PCR 儀器具有良好的適用性,性能穩定可靠。產品規格明確,提取試劑盒可處理 50 個樣品,檢測試劑盒可完成 50 次反應,整套體系從樣品前處理到定性檢測形成閉環,滿足生物制品生產各環節的支原體篩查需求。 上海細胞療法產品支原體檢測技術服務CAR-T 產品支原體檢測需在放行前快速完成,湖州申科快速版試劑盒 2.5 小時可出結果。
AdvSHENTEK外源因子全自動核酸檢測分析系統憑借優越性能,為支原體檢測提供堅實技術支撐。硬件方面,系統溫度運行精度≤0.5℃,溫度波動控制在 ±0.5℃以內,熒光強度 CV≤3%,確保檢測結果的重復性與準確性;4 通道單獨運行且支持同步檢測,通道可疊加延展,兼顧檢測效率與靈活性。軟件方面,系統具備三級權限管理、日志審計追蹤功能,完全符合 21CFR Part11 法規要求,支持 LIMS 系統連接、USB 數據導出及打印機直接打印,滿足企業合規追溯需求。此外,系統運輸與儲存便捷,儀器可常規運輸,檢測試劑盒在 2-8℃環境下即可穩定保存,無需特殊冷鏈條件,進一步提升了產品的實用性與適配性。
可比性驗證是支原體檢測 NAT 方法替代傳統檢測方法的關鍵依據,法規明確要求需將 NAT 法與藥典規定的傳統方法進行檢測限(LOD)對比。若以 NAT 法替代培養法,需證實其檢測限≤10CFU/mL;替代指示細胞培養法時,每種被測支原體的檢測限需≤100CFU/mL。對比實驗需采用相同樣本同步開展 NAT 檢測與傳統方法檢測,通過 CFU 可比性分析,確保兩種方法的檢測結果具有一致性。這一要求既保障了新方法的檢測效能不低于傳統標準,又為生物制品企業切換檢測方法提供了合規依據,兼顧了效率提升與質量**。 支原體檢測是生物制品質量控制的關鍵環節,需兼顧合規性與檢測效率。
支原體 NAT 檢測中異常曲線的出現多與操作設置、耗材使用或實驗環境相關,需針對性排查解決。首先需確認軟件設置正確性,對照試劑盒說明書檢查時間、溫度、循環數、熒光采集等參數,尤其需注意關閉不含 ROX 試劑的參比熒光功能。其次若擴增曲線無抬升卻出現 CT 值,需調整基線范圍,將起點設為熒光信號穩定的循環數,終點設為擴增曲線起峰前一個循環數。再者需確保耗材與儀器匹配,避免使用普通 PCR 耗材或與加熱模塊規格不符的反應管,防止熒光傳導不佳或熱傳導不充分。此外,曲線先上升后下降可能是反應液蒸發導致,上機前需檢查八連管管蓋無縫隙,避免液面下降干擾結果。 病毒收獲液、抗體 UPB 等中間產物需逐批檢測支原體,把控生產過程質量。上海支原體檢測
歐洲藥典(EP)2.6.7 認可 NAT 法作為支原體檢測替代方法,需通過檢測限與可比性驗證。上海重組藥物支原體檢測核酸擴增法
選擇合適的商業化支原體試劑盒需綜合五大主要維度,確保檢測合規、穩定與高效。一是監管認可度,需關注試劑盒驗證的全面性與室間驗證情況,菌株選擇是否合規,以及廠家是否有豐富的客戶申報案例;二是廠家資質,確認廠家是否接受供應商審計,能否提供 “產品 + 服務” 的全流程解決方案;三是產品設計,重點考察試劑盒方法學驗證的嚴謹性、對復雜樣品基質的耐用性與抗干擾能力,以及是否具備避免假陰 / 假陽性的質控設計,是否符合藥典要求;四是技術支持,評估廠家的技術響應速度、問題解決能力,能否提供專業的驗證指導;五是質量保障,關注試劑盒供應的穩定性與質量均一性,避免因產品批次差異影響檢測結果,確保長期質控需求的穩定滿足。 上海重組藥物支原體檢測核酸擴增法